أهم ما تحتاج معرفته حول حمض الكبريتيك
صفحة 1 من اصل 1
 أهم ما تحتاج معرفته حول حمض الكبريتيك
أهم ما تحتاج معرفته حول حمض الكبريتيك

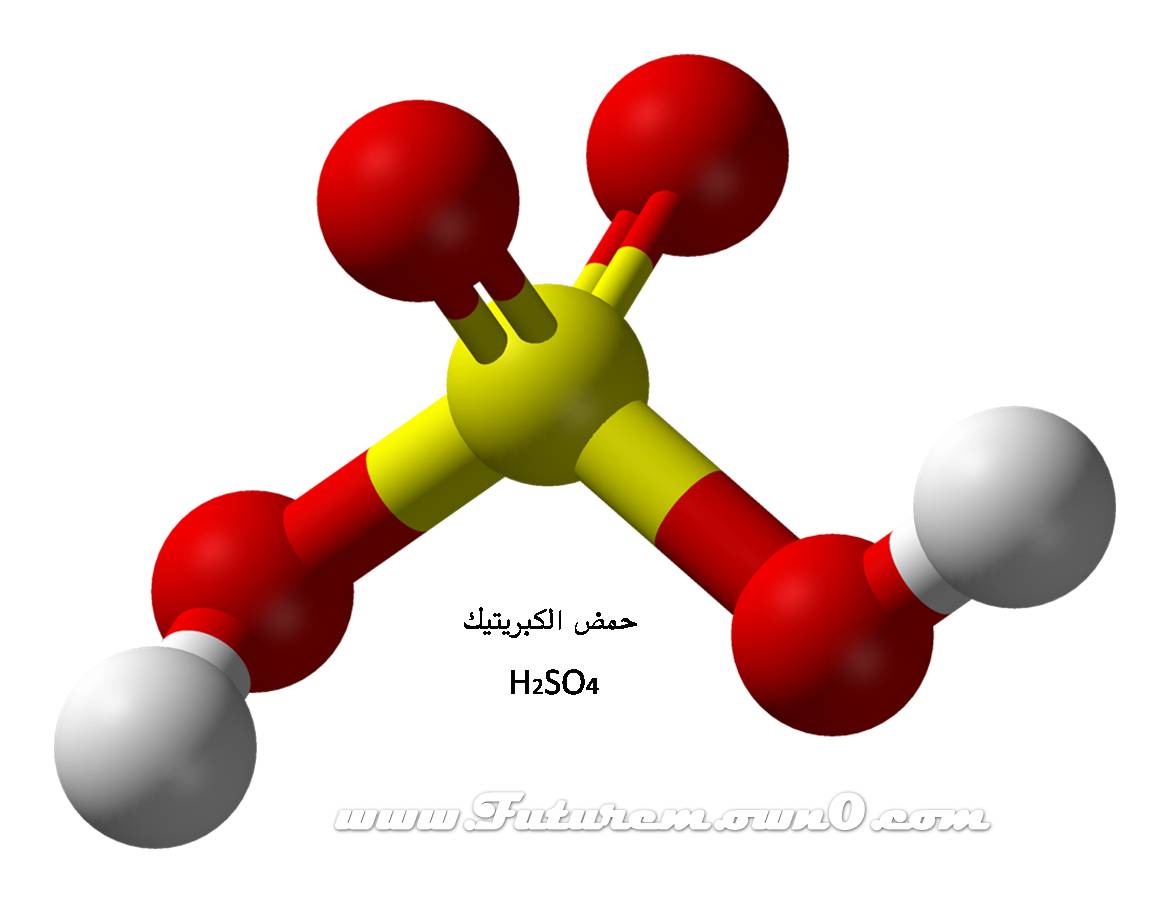
حمض الكبريتيك
حمض الكبريتيك (إنجليزية إنجلترا :Sulphuric acid
إنجليزية أمريكا :Sulfuric acid),
H2SO4, هو حمض معدني قوي.
وهو قابل للذوبان في الماء عند كل تركيزاته. وكان يـُعرف باسم زيت الزاج oil of vitriol, وهو الاسم الذي صاغه في القرن الثامن العالم المسلم
جابر بن حيان (Geber) بعد اكتشافه المركب الكيميائي. حمض الكبريتيك
له الكثير من التطبيقات, وهو أحد أهم المنتجات في الصناعات الكيماوية. وبلغ الانتاج
العالمي منه سنة 2001 نحو 165 مليون طن, بقيمة $8 بليون دولار. الاستخدامات الرئيسية
تتضمن معالجة خامات المعادن, صناعة الأسمدة, تكرير النفط, معالجة مياه المجاري, والتخليق
الكيميائي.
إنجليزية أمريكا :Sulfuric acid),
H2SO4, هو حمض معدني قوي.
وهو قابل للذوبان في الماء عند كل تركيزاته. وكان يـُعرف باسم زيت الزاج oil of vitriol, وهو الاسم الذي صاغه في القرن الثامن العالم المسلم
جابر بن حيان (Geber) بعد اكتشافه المركب الكيميائي. حمض الكبريتيك
له الكثير من التطبيقات, وهو أحد أهم المنتجات في الصناعات الكيماوية. وبلغ الانتاج
العالمي منه سنة 2001 نحو 165 مليون طن, بقيمة $8 بليون دولار. الاستخدامات الرئيسية
تتضمن معالجة خامات المعادن, صناعة الأسمدة, تكرير النفط, معالجة مياه المجاري, والتخليق
الكيميائي.
العديد من الپروتينات تحتوي على الكبريت
في الأحماض الأمينية (مثل سيستين cysteine ومثيونين
methionine) اللذان ينتجا حمض الكبريتيك خلال عملية الأيض
في الجسم البشري.
في الأحماض الأمينية (مثل سيستين cysteine ومثيونين
methionine) اللذان ينتجا حمض الكبريتيك خلال عملية الأيض
في الجسم البشري.
الوصف
حمض الكبريتيك سائل زيتي كثيف عديم اللون
حارق، وآكل جدًا، ويؤدي دورًا مهمًا في إنتاج كثير من السلع المصنعة التي يستخدمها
معظم الناس. ويصنف الكيميائيون حمض الكبريتيك بوصفه حمضًا معدنيًا قويًا وصيغته الكيميائية
هي: H2 SO4. ويعتبر حمض الكبريتيك واحدًا من أقوى الأحماض
ويمكنه حرق الجلد وتهييج النسيج المبطن للأنف، والقصبة الهوائية والرئتين. وتحمي معايير
الأمان في كثير من البلاد العمال من التعرض الزائد لحمض الكبريتيك أو لأبخرته.
حارق، وآكل جدًا، ويؤدي دورًا مهمًا في إنتاج كثير من السلع المصنعة التي يستخدمها
معظم الناس. ويصنف الكيميائيون حمض الكبريتيك بوصفه حمضًا معدنيًا قويًا وصيغته الكيميائية
هي: H2 SO4. ويعتبر حمض الكبريتيك واحدًا من أقوى الأحماض
ويمكنه حرق الجلد وتهييج النسيج المبطن للأنف، والقصبة الهوائية والرئتين. وتحمي معايير
الأمان في كثير من البلاد العمال من التعرض الزائد لحمض الكبريتيك أو لأبخرته.
__________________________________________
الخواص الفيزيائية
أشكال حمض الكبريتيك
بالرغم من إمكانية تحضير حمض الكبريتيك
بتركيز 100% إلا أنه يفقد SO3 عند درجة الغليان ويعطي حمض تركيزه
98.3% ينحل في الماء ناشرا كمية كبيرة من الحرارة نتيجة للتميه لذلك ينصح بالحذر عند
تمديد الحمض وذلك بصب الحمض فوق الماء وليس العكس لأنه شره جدا للماء لذلك يستعمل في
تجفيف الغازات الرطبة كما يخرب المواد العضوية والخلايا الحية لسحبه الماء منها. يعد
حمض الكبريت من أوائل الأحماض التي تم التعرف عليها، حيث عرفه العرب منذ القرن الثامن
الميلادي، وعرفته أوربا في القرنين الرابع والخامس عشر.
بتركيز 100% إلا أنه يفقد SO3 عند درجة الغليان ويعطي حمض تركيزه
98.3% ينحل في الماء ناشرا كمية كبيرة من الحرارة نتيجة للتميه لذلك ينصح بالحذر عند
تمديد الحمض وذلك بصب الحمض فوق الماء وليس العكس لأنه شره جدا للماء لذلك يستعمل في
تجفيف الغازات الرطبة كما يخرب المواد العضوية والخلايا الحية لسحبه الماء منها. يعد
حمض الكبريت من أوائل الأحماض التي تم التعرف عليها، حيث عرفه العرب منذ القرن الثامن
الميلادي، وعرفته أوربا في القرنين الرابع والخامس عشر.
أطلق جابر بن حيان على هذا الحمض قديماً
زيت الزاج ( Oil of Vitroil ) بسبب تحضيره من تسخين وتقطير الزاج الأخضر (
كبريتات الحديدوز المائية ) ، والكبريتات الأخرى المشابهة له. حمض الكبريتيك سائل عديم
اللون، زيتي القوام لا رائحة له عندما يكون نقياً، إلا أنه يعطي أحياناً رائحة غاز
ثالث أكسيد الكبريت (SO3 ) عند وجود هذا الغاز بنسبة عالية اثناء تحضير
الحمض . كما يتميز حامض الكبريتيك المركز بأنه موصل للتيار الكهربائي يتجمد حمض الكبريتيك
عند درجة حرارة 10 درجة مئوية، بينما يغلي حامض الكبريتيك المركز (100 % وزناً ) عند
درجة حرارة 330 درجة مئوية محرراً ثالث أكسيد الكبريت. تبلغ كثافة حامض الكبريتيك
1.84 جم / ملل
زيت الزاج ( Oil of Vitroil ) بسبب تحضيره من تسخين وتقطير الزاج الأخضر (
كبريتات الحديدوز المائية ) ، والكبريتات الأخرى المشابهة له. حمض الكبريتيك سائل عديم
اللون، زيتي القوام لا رائحة له عندما يكون نقياً، إلا أنه يعطي أحياناً رائحة غاز
ثالث أكسيد الكبريت (SO3 ) عند وجود هذا الغاز بنسبة عالية اثناء تحضير
الحمض . كما يتميز حامض الكبريتيك المركز بأنه موصل للتيار الكهربائي يتجمد حمض الكبريتيك
عند درجة حرارة 10 درجة مئوية، بينما يغلي حامض الكبريتيك المركز (100 % وزناً ) عند
درجة حرارة 330 درجة مئوية محرراً ثالث أكسيد الكبريت. تبلغ كثافة حامض الكبريتيك
1.84 جم / ملل
__________________________________________
الخواص الكيميائية
تختلف خواصه الكيماوية بحسب ما يكون ممدداأو
مركزا فحمض الكبريت الممدد يتفاعل مباشرة مع المعادن الواقعة قبل الهيدروجين في سلسلة
النشاط الكيماوي (الإزاحة) معطيا كبريتات المعدن ومطلقا الهيدروجين أما المعادن التي
تقع بعد الهيدروجين ك النحاس و الفضة فلا يتفاعل معها إلا بدخول مؤكسد قوي كالأوكسجين
أو حمض الآزوت ولا يتفاعل أبدا مع الذهب و البلاتين. أما حمض الكبريت المركز فيتفاعل
مع جميع المعادن الواقعة قبل وبعد الهيدروجين عدا الذهب والبلاتين ولكن بوجود الحرارة
ويعطي كبريتات المعدن وثنائي أكسيد الكبريت والماء . كما يتفاعل الحمض المركز مع اللامعادن
معطيا ثنائي اكسيد الكبريت و أكسيد اللامعدن والماء.
مركزا فحمض الكبريت الممدد يتفاعل مباشرة مع المعادن الواقعة قبل الهيدروجين في سلسلة
النشاط الكيماوي (الإزاحة) معطيا كبريتات المعدن ومطلقا الهيدروجين أما المعادن التي
تقع بعد الهيدروجين ك النحاس و الفضة فلا يتفاعل معها إلا بدخول مؤكسد قوي كالأوكسجين
أو حمض الآزوت ولا يتفاعل أبدا مع الذهب و البلاتين. أما حمض الكبريت المركز فيتفاعل
مع جميع المعادن الواقعة قبل وبعد الهيدروجين عدا الذهب والبلاتين ولكن بوجود الحرارة
ويعطي كبريتات المعدن وثنائي أكسيد الكبريت والماء . كما يتفاعل الحمض المركز مع اللامعادن
معطيا ثنائي اكسيد الكبريت و أكسيد اللامعدن والماء.
H2SO4 + H2O → H3O+ + HSO4−,
ثم بعد ذلك
HSO4− + H2O → H3O+ + SO42−.
تفاعلات أخرى لحمض الكبريتيك
CuO + H2SO4 → CuSO4 + H2O
H2SO4 + CH3COONa → NaHSO4 + CH3COOH
Fe(s) + H2SO4(aq) → H2(g) + FeSO4(aq)
Sn(s) + 2 H2SO4(aq) → SnSO4(aq) + 2 H2O(l) + SO2(g)
__________________________________________
الجوانب البيئية
يعتبر حمض الكبريتيك من مكونات الأمطار
الحمضية ، حيث يتكون من من أكسدة الأكسجين الجوي لثاني أكسيد الكبريت في وجود الماء.
(أكسدة حمض الكبريتوز ). ثاني أكسيد الكبريت هو الناتج الأساسي لعمليات حرق الكبريت
أو أحد أنواع الوقود الذي يحتوي على الكبريت مثل الفحم والزيت.
الحمضية ، حيث يتكون من من أكسدة الأكسجين الجوي لثاني أكسيد الكبريت في وجود الماء.
(أكسدة حمض الكبريتوز ). ثاني أكسيد الكبريت هو الناتج الأساسي لعمليات حرق الكبريت
أو أحد أنواع الوقود الذي يحتوي على الكبريت مثل الفحم والزيت.
2 FeS2 + 7 O2 + 2 H2O → 2 Fe2+ + 4 SO42− + 4 H+.
The Fe2+ can be further oxidized to
Fe3+, according to:
Fe3+, according to:
4 Fe2+ + O2 + 4 H+ → 4 Fe3+ + 2 H2O,
and the Fe3+ produced can be
precipitated as the hydroxide or hydrous oxide. The equation for the formation
of the hydroxide is
precipitated as the hydroxide or hydrous oxide. The equation for the formation
of the hydroxide is
Fe3+ + 3 H2O → Fe(OH)3 + 3 H+.
__________________________________________
حمض الكبريتيك في الفضاء الخارجي
حمض الكبريتيك يتم انتاجه في أعلى الغلاف
الجوي لكوكب الزهرة بواسطة المفعول الكيميائي الضوئي للشمس على ثاني اكسيد الكربون,
ثاني اكسيد الكبريت, و بخار الماء.
الجوي لكوكب الزهرة بواسطة المفعول الكيميائي الضوئي للشمس على ثاني اكسيد الكربون,
ثاني اكسيد الكبريت, و بخار الماء.
CO2 → CO + O
SO2 + O → SO3
SO3 + H2O → H2SO4
__________________________________________
إستخدامات حمض الكبريتيك
حمض الكبريتيك شديد الأهمية ، لدرجة أنه
يقاس تقدم الأمم بحجم إنتاجها لحمض الكبريتيك ويعطي مؤشراً جيداً. الاستخدام الرئيسي(60%
من العالم كله) لحمض الكبريتيك يكون في "الطريقة المبتلة" لإنتاج حمض الفوسفوريك
، الذي يستخدم في صناعة الأسمدة الفوسفاتية ، وكذالك فوسفات ثلاثي الصوديوم المستخدم
في صناعة المنظفات.
يقاس تقدم الأمم بحجم إنتاجها لحمض الكبريتيك ويعطي مؤشراً جيداً. الاستخدام الرئيسي(60%
من العالم كله) لحمض الكبريتيك يكون في "الطريقة المبتلة" لإنتاج حمض الفوسفوريك
، الذي يستخدم في صناعة الأسمدة الفوسفاتية ، وكذالك فوسفات ثلاثي الصوديوم المستخدم
في صناعة المنظفات.
Ca5F(PO4)3 + 5 H2SO4 + 10 H2O → 5
CaSO4•2 H2O + HF + 3 H3PO4.
CaSO4•2 H2O + HF + 3 H3PO4.
كبريتات الألومنيوم
Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O.
يستخدم حمض الكبريتيك بصفة رئيسية في صناعة
الأسمدة. وتستخدمه المصانع الأخرى لإنتاج سلع مثل بطاريات السيارات والمتفجرات، ومواد
الصباغة والحديد والمعادن الأخرى، ولب الورق. وتستخدم الصناعات الكيميائية حمض الكبريتيك
في إنتاج أنواع كثيرة من المواد العضوية، فهو على سبيل المثال يستخدم في صناعة الكحول
من الإيثيلين. ويتفاعل حمض الكبريتيك مع البنزين وغيره من المركَّبات الأخرى لصنع السلفونات
التي تستخدم في المواد المنظفة القوية، كما يستخدم أيضًا في صناعة الأصباغ والأدوية.
وقوة حمض الكبريتيك تجعله مفيدًا في إنتاج الأحماض الأخرى، وفي التخلص من المواد الذائبة
في المعادن. وكذلك فإن الكثير من المعادن تذوب في حمض الكبريتيك لتكون الكبريتات (أملاح
الحمض) ولها استخدامات مهمة في الصناعة. ويتحد حمض الكبريتيك بسرعة مع الماء. والجاذبية
الكيميائية القوية لحمض الكبريتيك للماء تساعده على إزالة الهيدروجين والأكسجين (العنصران
المكونان للماء). وفي كثير من المواد تجعله هذه الخاصية، مفيدًا بوصفه عامل تجفيف.
ويتضح هذا مع السكر الذي يحتوي على كربون وهيدروجين وأكسجين. فعندما يتم صب حمض الكبريتيك
على السكَّر، فإن الخليط يتحلل ويتحول إلى كربون رغوي أسود (فحم نباتي). ويتفاعل الماء
وحمض الكبريتيك المركَّز بشدة عند خلطهما، حيث يصبح الخليط في حالة غليان شديد. ويجب
إضافة كميات صغيرة من حمض الكبريتيك إلى الماء ببطء وحرص، ولا يضاف الماء إلى حمض الكبريتيك
لأن هذا الإجراء ينتج عنه تطاير شديد. ويحتوي حمض الكبريتيك أحيانًا على مزيد من ثالث
أكسيد الكبريت وهي مادة كيميائية ينبعث منها الغاز عندما تتحد مع الرطوبة التي في الجو.
ويطلق الكيميائيون على هذا النوع من حمض الكبريتيك الزيت أو حمض الكبريتيك المتبخر،
ويتم استخدامه في إحدى طرق تصنيع حمض الكبريتيك.
الأسمدة. وتستخدمه المصانع الأخرى لإنتاج سلع مثل بطاريات السيارات والمتفجرات، ومواد
الصباغة والحديد والمعادن الأخرى، ولب الورق. وتستخدم الصناعات الكيميائية حمض الكبريتيك
في إنتاج أنواع كثيرة من المواد العضوية، فهو على سبيل المثال يستخدم في صناعة الكحول
من الإيثيلين. ويتفاعل حمض الكبريتيك مع البنزين وغيره من المركَّبات الأخرى لصنع السلفونات
التي تستخدم في المواد المنظفة القوية، كما يستخدم أيضًا في صناعة الأصباغ والأدوية.
وقوة حمض الكبريتيك تجعله مفيدًا في إنتاج الأحماض الأخرى، وفي التخلص من المواد الذائبة
في المعادن. وكذلك فإن الكثير من المعادن تذوب في حمض الكبريتيك لتكون الكبريتات (أملاح
الحمض) ولها استخدامات مهمة في الصناعة. ويتحد حمض الكبريتيك بسرعة مع الماء. والجاذبية
الكيميائية القوية لحمض الكبريتيك للماء تساعده على إزالة الهيدروجين والأكسجين (العنصران
المكونان للماء). وفي كثير من المواد تجعله هذه الخاصية، مفيدًا بوصفه عامل تجفيف.
ويتضح هذا مع السكر الذي يحتوي على كربون وهيدروجين وأكسجين. فعندما يتم صب حمض الكبريتيك
على السكَّر، فإن الخليط يتحلل ويتحول إلى كربون رغوي أسود (فحم نباتي). ويتفاعل الماء
وحمض الكبريتيك المركَّز بشدة عند خلطهما، حيث يصبح الخليط في حالة غليان شديد. ويجب
إضافة كميات صغيرة من حمض الكبريتيك إلى الماء ببطء وحرص، ولا يضاف الماء إلى حمض الكبريتيك
لأن هذا الإجراء ينتج عنه تطاير شديد. ويحتوي حمض الكبريتيك أحيانًا على مزيد من ثالث
أكسيد الكبريت وهي مادة كيميائية ينبعث منها الغاز عندما تتحد مع الرطوبة التي في الجو.
ويطلق الكيميائيون على هذا النوع من حمض الكبريتيك الزيت أو حمض الكبريتيك المتبخر،
ويتم استخدامه في إحدى طرق تصنيع حمض الكبريتيك.
دورة الكبريت واليود
The دورة الكبريت-اليود هس سلسلة
من العمليات الكيميائية الحرارية المستخدمة للحصول على الهيدروجين. وتتكون من ثلاث
تفاعلات كيميائية مفاعهم الخالص هو الماء ومنتجاتهم الخالصة هي الهيدروجين والأكسجين.
من العمليات الكيميائية الحرارية المستخدمة للحصول على الهيدروجين. وتتكون من ثلاث
تفاعلات كيميائية مفاعهم الخالص هو الماء ومنتجاتهم الخالصة هي الهيدروجين والأكسجين.
2 H2SO4 → 2 SO2 + 2 H2O + O2 (830°C)
I2 + SO2 + 2 H2O → 2 HI + H2SO4 (120°C)
2 HI → I2 + H2 (320°C)
__________________________________________تحضير حمض الكبريتيك
وصفت عملية التحضير التجاري لحمض الكبريتيك
في القرن السادس عشر الميلادي. أما اليوم، فيتم تصنيع الحمض أساسًا من الكبريت بإحدى
طريقتين: طريقة التلامس وطريقة غرفة الرصاص وهي طريقة قديمة. وتنتج طريقة التلامس حمض
الكبريتيك أنقى وأكثر تركيزًا من طريقة غرفة الرصاص. ويتم تصنيع ثالث أكسيد الكبريت
بطريقة التلامس عن طريق تمرير غاز ثاني أكسيد الكبريت العديم اللون من خلال أنبوب ساخن
يحتوي إما على الفاناديوم أو البلاتين اللذين يقومان بدور الحفَّاز.فيذوب ثالث أكسيد
الكبريت في حمض الكبريتيك المركز مكونًا الزيت الذي يضاف إلى الماء لإنتاج حمض الكبريتيك
بأي تركيز مطلوب. وتبدأ طريقة غرفة الرصاص بحرق الكبريت لتكوين ثاني أكسيد الكبريت
الذي يتفاعل بعد ذلك مع مركبات النيتروجين التي تسمى أكاسيد النتريك وذلك داخل غرفة
مبطنة بالرصاص لتنتج حمض الكبريتيك. وهذه الطريقة الثانية ليست مكلفة ولكنها تنتج حمضًا
ضعيفًا نسبيًا. ويمكن إنتاج حمض الكبريتيك من ثاني أكسيد الكبريت الذي نحصل عليه كمنتج
ثانوي بتحميص النحاس وبيريت الحديد وغيرهما من خامات الكبريت الأخرى، وتستخدم عملية
التحميص في فصل وتنقية خامات المعادن عن طريق تسخينها في الهواء. ويمكن أن تزودنا محطات
توليد الكهرباء التي تحرق الفحم كوقود، بمصدر أساسي وعملي لحمض الكبريتيك وذلك في المستقبل،
حيث يمكن إنتاج حمض الكبريتيك من ثاني أكسيد الكبريت الناتج عن تنقية الغازات المنطلقة
خلال احتراق الفحم. ولكن الشوائب الكثيرة الموجودة بهذه الغازات تجعل من الصعب تجميع
ثاني أكسيد الكبريت بهذه الصورة. وكذلك نجد أن المكان البعيد لمحطات توليد الطاقة يُصعِّب
مشكلة نقل حمض الكبريتيك الذي هو مادة آكلة وحارقة جدًا.
__________________________________________في القرن السادس عشر الميلادي. أما اليوم، فيتم تصنيع الحمض أساسًا من الكبريت بإحدى
طريقتين: طريقة التلامس وطريقة غرفة الرصاص وهي طريقة قديمة. وتنتج طريقة التلامس حمض
الكبريتيك أنقى وأكثر تركيزًا من طريقة غرفة الرصاص. ويتم تصنيع ثالث أكسيد الكبريت
بطريقة التلامس عن طريق تمرير غاز ثاني أكسيد الكبريت العديم اللون من خلال أنبوب ساخن
يحتوي إما على الفاناديوم أو البلاتين اللذين يقومان بدور الحفَّاز.فيذوب ثالث أكسيد
الكبريت في حمض الكبريتيك المركز مكونًا الزيت الذي يضاف إلى الماء لإنتاج حمض الكبريتيك
بأي تركيز مطلوب. وتبدأ طريقة غرفة الرصاص بحرق الكبريت لتكوين ثاني أكسيد الكبريت
الذي يتفاعل بعد ذلك مع مركبات النيتروجين التي تسمى أكاسيد النتريك وذلك داخل غرفة
مبطنة بالرصاص لتنتج حمض الكبريتيك. وهذه الطريقة الثانية ليست مكلفة ولكنها تنتج حمضًا
ضعيفًا نسبيًا. ويمكن إنتاج حمض الكبريتيك من ثاني أكسيد الكبريت الذي نحصل عليه كمنتج
ثانوي بتحميص النحاس وبيريت الحديد وغيرهما من خامات الكبريت الأخرى، وتستخدم عملية
التحميص في فصل وتنقية خامات المعادن عن طريق تسخينها في الهواء. ويمكن أن تزودنا محطات
توليد الكهرباء التي تحرق الفحم كوقود، بمصدر أساسي وعملي لحمض الكبريتيك وذلك في المستقبل،
حيث يمكن إنتاج حمض الكبريتيك من ثاني أكسيد الكبريت الناتج عن تنقية الغازات المنطلقة
خلال احتراق الفحم. ولكن الشوائب الكثيرة الموجودة بهذه الغازات تجعل من الصعب تجميع
ثاني أكسيد الكبريت بهذه الصورة. وكذلك نجد أن المكان البعيد لمحطات توليد الطاقة يُصعِّب
مشكلة نقل حمض الكبريتيك الذي هو مادة آكلة وحارقة جدًا.
مع تحياتي للجميع
المصدر: المعرفة
صفحة 1 من اصل 1
صلاحيات هذا المنتدى:
لاتستطيع الرد على المواضيع في هذا المنتدى
 الرئيسية
الرئيسية أحدث الصور
أحدث الصور العاب
العاب حالة الطقس
حالة الطقس إتصل بنا
إتصل بنا دخول
دخول
» النقل النشط
» تركيب الخلية(الحيوانية\النباتية)
» طلب في الأحياء سنة تالتة
» طلب في الكيمياء سنة تالتة
» الغازات النبيلة (العناصر الخاملة)
» تجربة للتدليل على إزاحة المحاليل
» الانزيمات ووظئفها
» الطرق التي يتم بها نقل المواد عبر غشاء الخلية
» توزيع الدرجات الأخير لثانوية (9\6\2010).
» تقسيم المقررات الدراسية لشعبة علوم الحياة 2012.
» الملاريا,كل ما يتعلق بها
» من هو جابر بن حيان
» من هو جابر بن حيان
» من هو جابر بن حيان
» من هو جابر بن حيان
» صور, الخيل العربي الاصيل
» برنامج محاكاة الحاسوب ,لعمل تجارب افتراضية علي الكمبيوتر
» طلب في الاحياء سنة اولى
» مقارنة أنواع الوقود